时间:2021-10-08 访问量:2046 来源:新征程
mRNA疫苗已被COVID-19大流行推向生物技术和制药工业的中心阶段。由BioNTech/Pfizer、Moderna、CureVac、Sanofi/TranslateBio、Arcturus/Duke-NUS Medical School in Singapore、Imperial College London、Chulalongkorn University in Thailand和Providence Therapeutics领导的mRNA疫苗有8项正在进行的人体试验[1]。值得注意的是,其中两项试验宣布了3期中期试验结果,报告了在脂质纳米颗粒中递送2剂30µg或100µg编码尖峰蛋白免疫原的mRNA序列后,获得SARS-CoV-2感染降低超过94%的疗效[2,3]。疫苗开发的速度也超过了预期,这些结果仅发生在SARS-CoV-2序列公开后10个月。这一成功不仅证明了生物技术和制药行业能够应对全球迫切和未满足的需求,而且证明了mRNA作为一种药物方式的固有能力,在这种情况下是一种预防性疫苗。本综述的目的是概述mRNA递送系统的开发,然后总结SARS-CoV-2 mRNA疫苗的临床前和临床结果,并将其与有助于其成功的递送系统特征相关联。最近发表了几篇关于COVID-19前疫苗和治疗药物的mRNA递送系统的优秀综述[4,5,6,7,8,9,10,11,12,13,14,15,16]。
与其他药物方式相比,信使RNA治疗药物具有许多优势和几个挑战,包括小分子、DNA、寡核苷酸、病毒系统和蛋白质,包括抗体。与寡核苷酸和大多数小分子药物靶标相比,介导刺激和抑制作用模式的能力,以及表达或替代缺陷蛋白的能力,扩大了其使用的潜在适应症范围。与DNA相比,mRNA只需要进入细胞质核糖体翻译机器而不是细胞核,不会冒基因组整合的风险。与蛋白质和病毒系统相比,mRNA制造是无细胞的,更快,蛋白质产物具有天然的糖基化和构象特性。当与脂质纳米颗粒(LNP)递送系统结合时,mRNA LNP的纳米结构特性在其大小、脂质包膜方面也与病毒系统和循环中的内源性、含脂质的乳糜微粒相似,对于病毒系统,有助于其作为疫苗和其他治疗药物递送载体应用的内部基因组材料[17]。
mRNA平台的挑战是其固有的免疫原性、对酶降解的易感性和几乎可忽略不计的细胞对裸mRNA的摄取水平。mRNA的固有免疫原性是由于toll样受体(TLRs)、解旋酶受体,包括维甲酸诱导基因i(RIG-i)样受体(RLRs)和其他[18,19]对单链和双链RNA的细胞检测,然后通过NF-κB和干扰素(IFN)调节因子IRF3和IRF7发出信号,转移到细胞核与I型IFN基因启动子结合,诱导I型IFN(IFN-α和IFN-β)的表达,并伴随促炎性细胞因子,如肿瘤坏死因子-a(TNF-α)、IL-6和IL-12[20]。分泌的干扰素在同一细胞和相邻细胞中通过其受体和JAK/STAT通路发出信号,激活300多个IFN刺激基因,包括蛋白激酶PKR,作为一般的病毒防御机制。虽然这种激活可能有利于增强对mRNA疫苗的免疫反应,但一个直接的作用是通过eIF2a的PKR磷酸化下调翻译,从而损害eIF2的活性,抑制mRNA翻译,从而抑制免疫原的蛋白质合成[21]。消除这种先天性免疫应答的主要方法是将天然存在的核苷,如1-甲基假尿嘧啶核苷[22]和转移中存在的其他核苷以及核糖体RNA(但不是mRNA中的典型核苷)替代到mRNA序列中,然后通过这些先天性免疫传感器使其检测不到[23,24]。这种核苷修饰的免疫测序mRNA平台是mRNA技术的基础,最近在BioNTech/Pfizer和Moderna SARS-CoV-2疫苗试验中显示了 > 94%的有效性,建立在之前针对其他病原体的试验基础上,详述如下。CureVac追求的第二种方法是涉及密码子优化和尿苷去除的序列工程[25],因为TLR7和TLR8主要识别富含GU的单链RNA序列[26]。mRNA治疗的第二个挑战是其对核酸酶的敏感性,例如在血清中的半衰期 < 5 min[27]。尽管siRNA的化学修饰在改善稳定性和降低免疫原性方面非常成功[28],但迄今为止,由于翻译机制对这些修饰的敏感性,它们对mRNA并不成功[29]。mRNA的第三个挑战是在大多数细胞类型中缺乏裸mRNA的细胞摄取[30],不成熟的树突状细胞除外[31]。最后两个挑战是通过将核苷修饰或序列工程的mRNA掺入到递送系统中来解决的,该系统既保护mRNA免受酶攻击,又促进细胞摄取。例如,当在动物模型中给药时,与裸mRNA相比,掺入脂质纳米颗粒可保护mRNA免受酶攻击,并使细胞摄取和表达增加高达1000倍[32,33]。
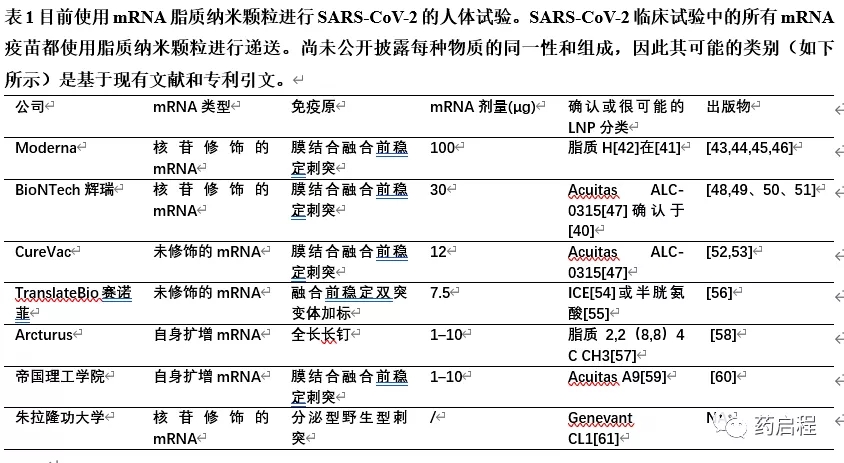
治疗性mRNA由质粒DNA骨架的体外转录(IVT)产生,产生带有5′帽、5′非翻译序列(UTR)、编码目标蛋白的开放阅读框、3′UTR和polyA尾的全长信息[4]。天然真核生物5′帽子(cap0)是一种倒置的7-甲基鸟苷(m7G),通过5′~5′三磷酸与mRNA的第一个核苷酸连接。Cap0保护内源性mRNA免受核酸酶攻击,参与核输出并与翻译起始因子4结合开始蛋白翻译。已发现另外两个5′帽(cap1和cap2)在第二或第三核糖核苷酸上含有额外的甲基,免疫原性低于cap0(因此首选)[34]。目前常用的封端方法涉及共转录封端过程,产生cap1,其具有高翻译和低免疫原性[35]。5’UTR参与翻译起始,可以包含一个Kozak序列以及一个内部核糖体进入位点进行帽-非依赖性翻译[36]。开放阅读框之后是3’UTR,它影响mRNA的稳定性和蛋白表达的持久性。polyA尾部编码在约100个残基处,有助于启动翻译和延迟降解。IVT产生mRNA后需要仔细纯化,以除去具有免疫原性的DNA和双链RNA污染物[37,38]。上述mRNA可以是核苷修饰的,也可以是没有核苷修饰的序列改造的,但不能自我复制。能够复制的自扩增mRNA(samRNA)也正在SARS-CoV-2的临床试验中进行测试,并且是更长的~10 kb序列,因为它们包含四个额外编码的非结构基因,包括RNA依赖的RNA聚合酶,导致细胞内自我复制,但不产生感染性颗粒,因为其缺乏结构基因[39]。samRNA不能被核苷修饰,因为这些修饰会干扰自我扩增。由于扩增过程,在当前的COVID-19临床试验中,samRNA通常使用较低剂量(1-10µg),而非扩增mRNA则为30-100µg。有趣的是,上述所有类别的mRNA疫苗目前正在SARS-CoV-2的人体临床试验中进行测试,并总结在表1中。这些临床试验中的所有mRNA递送系统都是脂质纳米颗粒。Pfizer-BioNTech LNP[40]和Moderna LNP[41]的确切组成已公开披露,而其他一些尚未公开。其他化合物最有可能与Alnylam Onpattro™产品(在下文进一步描述)相似,但具有专有的可电离脂质,披露的情况也是如此。尽管并非所有情况下均已知使用的特定可电离脂质,但可从期刊和专利出版物中了解其一般类别,如表1所示。
COVID-19前,mRNA疫苗用于包括流感、寨卡、HIV、埃博拉病毒、狂犬病、基孔肯雅热、疟疾、生殖器疱疹、弓形虫和其他传染病的临床前和临床研究。这些研究总结在许多近期优秀的综述中[4,6,16,39]。
mRNA的早期递送系统
精蛋白是一种富含精氨酸的小阳离子蛋白混合物,已被用于与mRNA形成复合物,与裸mRNA相比,可改善转染[62]。随后,引入了游离mRNA与鱼精蛋白复合物mRNA的混合物[63],因为鱼精蛋白复合物mRNA部分抑制了蛋白表达[64]。动态光散射表明,游离mRNA的大小接近50 nm,而鱼精蛋白/mRNA复合物在250–350 nm范围内[63]。CureVac对狂犬病候选疫苗CV7201采用了这种方法,CV7201是一种冻干、温度稳定的非修饰mRNA,由编码狂犬病病毒糖蛋白(RABV-G)的游离和鱼精蛋白复合物mRNA组成[65]。在Balb/c小鼠中,≥10µg的两次给药诱导的中和滴度大于WHO保护阈值,80µg剂量给药两次可预防致死性脑内激发[66]。在使用80-640µg剂量通过皮内和肌内途径给药的1期人体试验中,仅使用特定注射器接受3次80-400µg剂量的受试者亚组达到WHO中和滴度阈值[67]。最高剂量组101例受试者中有1例发生严重不良事件(面神经麻痹),所有受试者中有5%发生征集性重度不良事件。所有不良事件的总体发生率较高,97%发生注射部位反应,78%发生全身不良事件。鉴于鱼精蛋白复合物mRNA的递送次优,CureVac采用了Acuitas的脂质纳米颗粒递送系统[47,68],在Balb/c小鼠中以较低剂量0.5µg(鱼精蛋白复合物mRNA为10µg)给药20倍,在非人灵长类动物中以较低剂量10µg给药时,中和滴度显著改善[69]。T细胞反应的激活以及引流淋巴结和注射部位IL-6和TNF的存在表明LNP在介导阳性免疫反应中的作用。已启动临床试验(NCT03713086),预计将于2021年报告中期结果。
将阳离子脂质DOTAP与市售佐剂(MF59)(含角鲨烯、山梨醇三油酸酯和聚山梨酯80的柠檬酸盐缓冲液,pH 6.5)结合,开发了用于mRNA递送的阳离子纳米乳剂(CNE)[70]。联合使用编码呼吸道合胞病毒糖蛋白(RSV-f)的自扩增mRNA和NP胺(来自DOTAP)与磷酸盐(mRNA)的比值为7,得到平均129 nm大小的纳米颗粒。这种方法的一个优点是能够分别储存CNE和mRNA,并仅在使用时将其结合。15µg剂量在Balb/c小鼠中给药两次,引起的中和滴度高于佐剂亚单位疫苗。使用2剂75µg剂量在非人灵长类动物中达到可检测的中和滴度和T细胞应答。基于这一概念,一个单独的小组创建了纳米结构脂质载体(NLC),它是CNE和脂质纳米颗粒之间的混合物,由液态油相(如角鲨烯)和饱和甘油三酯组成的固相脂质组成[71]。含有编码梅花鹿免疫原的自扩增mRNA的NLC粒径为40 nm,NP比值为15,单次注射低至0.1µg或0.01µg的剂量后,能够在C57BL/6小鼠中产生保护性中和滴度。
mRNA递送的聚合物
阳离子聚合物已被广泛用于核酸递送几十年,包括例如聚(L-赖氨酸)、聚乙烯亚胺(PEI)、DEAE-葡聚糖、聚(β-氨基酯)(PBAE)和壳聚糖。以最简单的形式,阳离子聚合物与核酸过量混合,形成静电结合的阳离子多聚体。尽管已经开发了许多聚合物,但它们并不像用于核酸递送的脂质纳米颗粒那样先进,将其成功应用于疫苗的动物研究数量有限。PBAE与聚乙二醇(PEG)脂质共同配制,形成mRNA/PBAE/PEG脂质纳米颗粒,小鼠静脉给药后能够将mRNA功能性递送至肺部[72]。已使用促红细胞生成素作为基因递送的IV给药后报告物,检查了生物可降解聚合物聚(胺-共酯)(PACE)三元聚合物的mRNA递送[73]。通过控制分子量和末端基团化学,PACE家族的一个10 kDa成员实现了与TransIT相同的体外转染效率,TransIT是一种强效但有毒的胶体不稳定和大尺寸的商业参考。20µg IV剂量下EPO的体内表达是TransIT的5倍。合成超支化聚β氨基酯(hPBAEs),通过吸入将mRNA递送至肺。hPBAE mRNA多聚体的大小为137 nm,雾化吸入小鼠后能够转染25%的肺内皮,且没有明显毒性,表达水平是分支PEI的10倍[74]。合成了分子量范围为8 kDa至167 kDa的二硫键连接聚(酰胺胺)pABOL,能够在100 nm附近形成多分散纳米复合物[75]。使用自扩增mRNA报告基因的这些多聚体的体内荧光素酶表达与肌内给药后PEI相似。当以初免-加强设计递送至具有血凝素(HA)流感免疫原的小鼠时,低分子量8 kDa pABOL的中和滴度最高,并超过PEI。递送1µg HA自我扩增mRNA的8 kDa pABOL也对致死性流感激发具有部分保护作用,可预防死亡,但不能预防显著体重减轻。伦敦帝国理工学院认为该pABOL系统用于递送SARS-CoV-2的自扩增mRNA免疫原;然而,用pABOL递送SARS-CoV-2免疫原的效力比用Acuitas优化的脂质纳米颗粒递送相同免疫原的效力低1000倍[59]。总体而言,pABOL中1µg自扩增RNA产生的结合抗体和中和滴度与优化脂质纳米颗粒中0.001µg相同。许多其他聚合物系统能够在体外或体内递送mRNA,但仍有待在疫苗背景下进行检测[76,77,78,79,80,81,82,83,84]。

Copyright © 2024 北京循生生物医学研究有限公司 All Rights Reserved. 京ICP备2021023191号