时间:2021-10-08 访问量:1824 来源:E药经理人
异体基因治疗“先行者”Allogene正面临一场风暴。
近日,据外媒报道,在Allogene公司的一项在研细胞疗法ALLO-501A的早期研究中,一名患者在其CAR - T细胞中出现了“染色体异常”,因此FDA叫停了该公司的临床试验。
消息传出后,Allogene的股价暴跌了39%,市值缩减逾10亿美元。
Allogene周四收盘后表示,公司希望在与FDA协商后的几周内提供更多的更新信息,FDA将继续积极审查在ALLO-501A关键性试验前提交的第一阶段的材料情况。
据悉ALLO-501A是Allogene的主要候选药物之一,此前媒体报道该产品有望在今年晚些时候进入非霍奇金淋巴瘤的II期临床研究。
这并不是一次被动的暂停。
根据Allogene的说法,本次暂停是基于该公司向FDA通知“一名ALPHA2 研究患者在进行骨髓活检以评估全血细胞减少症(低血细胞计数)时检测到染色体异常。”该患者由于制造故障无法完成自体治疗后,来到了异体的CAR-T试验。“
在进行ALLO-501A输液后,患者经历了1级CRS(细胞因子释放综合征)和2级ICANS(免疫效应细胞相关神经毒性综合征),这需要一个疗程的高剂量类固醇治疗。”Allogene报告道。
“患者随后出现进行性全血细胞减少症,骨髓活检显示有再生障碍性贫血,并存在具有染色体异常的ALLO-501A CAR-T细胞。早期的转化数据显示,CAR-T细胞扩增在第28天达到峰值,此后出现收缩。患者对ALLO-501A有部分反应,随后接受了同种异体干细胞移植。在自体CAR-T疗法中已经报道了需要挽救性干细胞移植的长期血细胞减少症
Allogene首席执行官David Chang表示,现在还为时过早,但Allogene的研究团队确实有一些想法。首先,基因核酸酶的使用“会导致染色体变化”,这在临床前工作中已经看到。此外,任何人体内的T细胞“经历快速扩张都会发生变化,包括突变和染色体变化……而这种扩张可能导致了这种情况。”
安全问题长期以来一直困扰着CAR-T领域,首先是在David Chang和Kite的开拓者们开发出第一个使用他们自己的细胞进行个性化或自体治疗。现在,新的问题已经出现,在这一过程中任何消息都将受到密切关注,但David Chang和他的团队比任何人都更了解其中的危险。
2018年4月,Kite的创始人、首席执行官Arie Belldegrun携手原 Kite研发执行副总裁兼首席医学官 David Chang博士再起东山,高调宣布成立Allogene Therapeutics公司。
据外媒报道,成立之初Allogene便与辉瑞达成股权收购合作,通过收购辉瑞过去对Cellectis的投资组合,获得了UCART19在美国研发和商业化的权益,以及被认为包括BCMA和EGFRvIII的16个未公开的临床前目标。Cellectis是基因治疗领域的先驱。同时,作为回报Pfizer获得Allogene 25%的股份。
彼时Cellectis的CEO André Choulika认为,Allogene的研发团队加上Cellectis在基因编辑方面的优势会加速通用型CAR-T疗法的开发,最早会在2021年或2022年开启其商业化进程。
基于丰富的产品管线和强大的创始团队背景,Allogene可谓“含着金钥匙出生”,成立时便获得了3亿美元的A轮融资。当时媒体称该轮融资为生物技术历史上最大的A轮融资,投资人包括TPG、维达创投(Vida Ventures)、BellCo Capital、加州大学首席投资官办公室和辉瑞公司。
2019年1月,FDA批准了ALLO-501A新药IND申请,ALLO-501A为一种抗CD19 通用型CAR-T疗法,用于复发/难治性非霍奇金淋巴瘤患者)的1/2期递增研究(ALPHA)临床试验。
2020年5月Allogene在ASCO年会上提交ALLO-501在复发/难治性大B细胞淋巴瘤或滤泡性淋巴瘤(R/R LBCL/FL)中进行的Ⅰ期剂量递增研究的首批数据作为摘要。并公布了ALLO-501三线及以上治疗复发难治性非霍奇金淋巴瘤(NHL)的Ⅰ期临床研究(ALPHA)取得的积极数据。此后半月Allogene股价上涨了近60%。
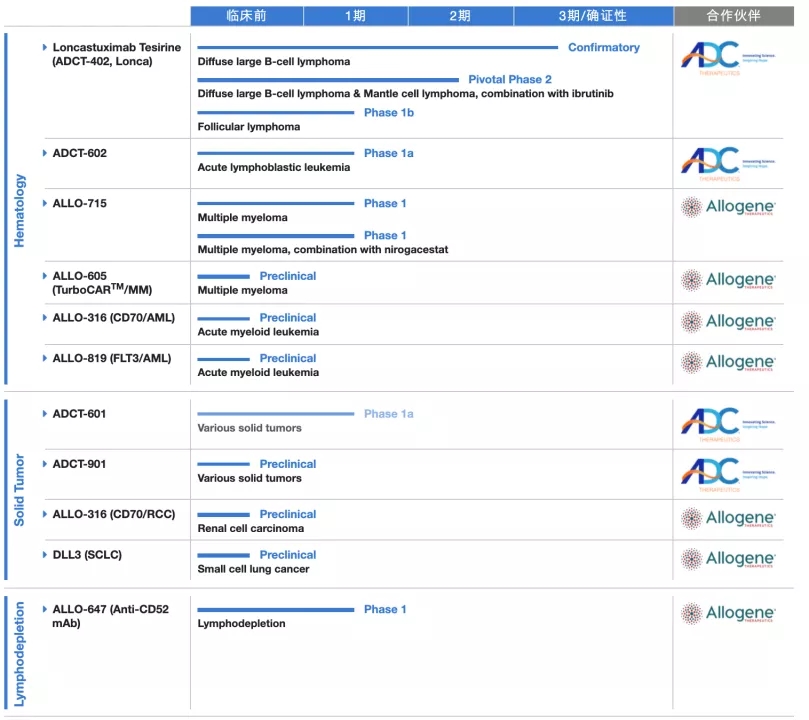
三年半过去,如今Allogene已经形成了规模化的在研管线,包括对实体瘤领域的探索。(其管线如下:)

不过为外界所不知道的是,悄然间这家基因治疗“先行者”已经将其版图扩展至中国。
2020年12月,Allogene与瓴路药业宣布成立Allogene Overland Biopharm。该合资公司将专注于在大中华区、台湾、韩国和新加坡开发、制造和商业化Allo CAR-T疗法。Allogene Overland将拥有在许可区域内开发、制造和商业化针对BCMA、CD70、FLT3和DLL3的特定异基因候选产品的独家许可。合资公司还将寻求机会,推动针对这些靶标的Allo CAR-T疗法的全球发展。
彼时新闻称,瓴路药业将投资1.17亿美元,其中包括向Allogene支付的4000万美元首付款,以及用于支持合资公司运营的7700万美元资金。每款产品在中国首次获得监管批准后,Allogene公司将有资格获得相应的里程碑付款以及基于净销售额的提成。
如今,瓴路药业的产品管线中超过一半的在研产品来自于Allogene,不过并不包含ALLO-501(A)。
瓴路药业背后的支持者是高瓴资本,于去年12月宣布正式启动,该公司由高瓴Venture Partner牟骅博士和高瓴Venture Partner张晓雷先生共同创立。牟骅博士担任瓴路药业临任首席执行官兼首席医学官,张晓雷先生担任瓴路药业首席运营官兼首席商务官。据了解瓴路药业启动当月便抛出了两笔合作,分别在大中华区等地区开发抗体偶联药物(ADC)和即用型(off-the-shelf)同种异体CAR-T疗法。其中CAR-T疗法公司便是与Allogene的合作。

Copyright © 2024 北京循生生物医学研究有限公司 All Rights Reserved. 京ICP备2021023191号